编者按:第一期“诺华NET之声”推出后,反响热烈。本篇文章为2019年第二期,精选了7篇2019年1月前后“新鲜出炉”的神经内分泌肿瘤领域重磅研究文献。内容涵盖了神经内分泌肿瘤流行病学研究、基于RADIANT系列研究的神经内分泌肿瘤基因组分析、神经内分泌肿瘤免疫检查点最新探索结果、晚期神经内分泌肿瘤真实世界治疗模式与结局以及2项分别分析直肠、胰腺神经内分泌肿瘤转移及术后复发危险因素的回顾性研究。
本期特别邀请复旦大学附属肿瘤医院胰腺外科徐近教授对一篇关于RADIANT系列研究基因检测的文章进行了深度精彩点评。本期内容十分丰富,希望能激发广大临床工作者对NET发病模式、生物学行为以及未来治疗方向等有更多、更深入的思考。
1. NETs的基因组分析:RADIANT系列研究的综合分析
Genomic profiling of NETs: a comprehensive analysis of the RADIANT trialsEndocrine-Related Cancer [ IF=5.331]
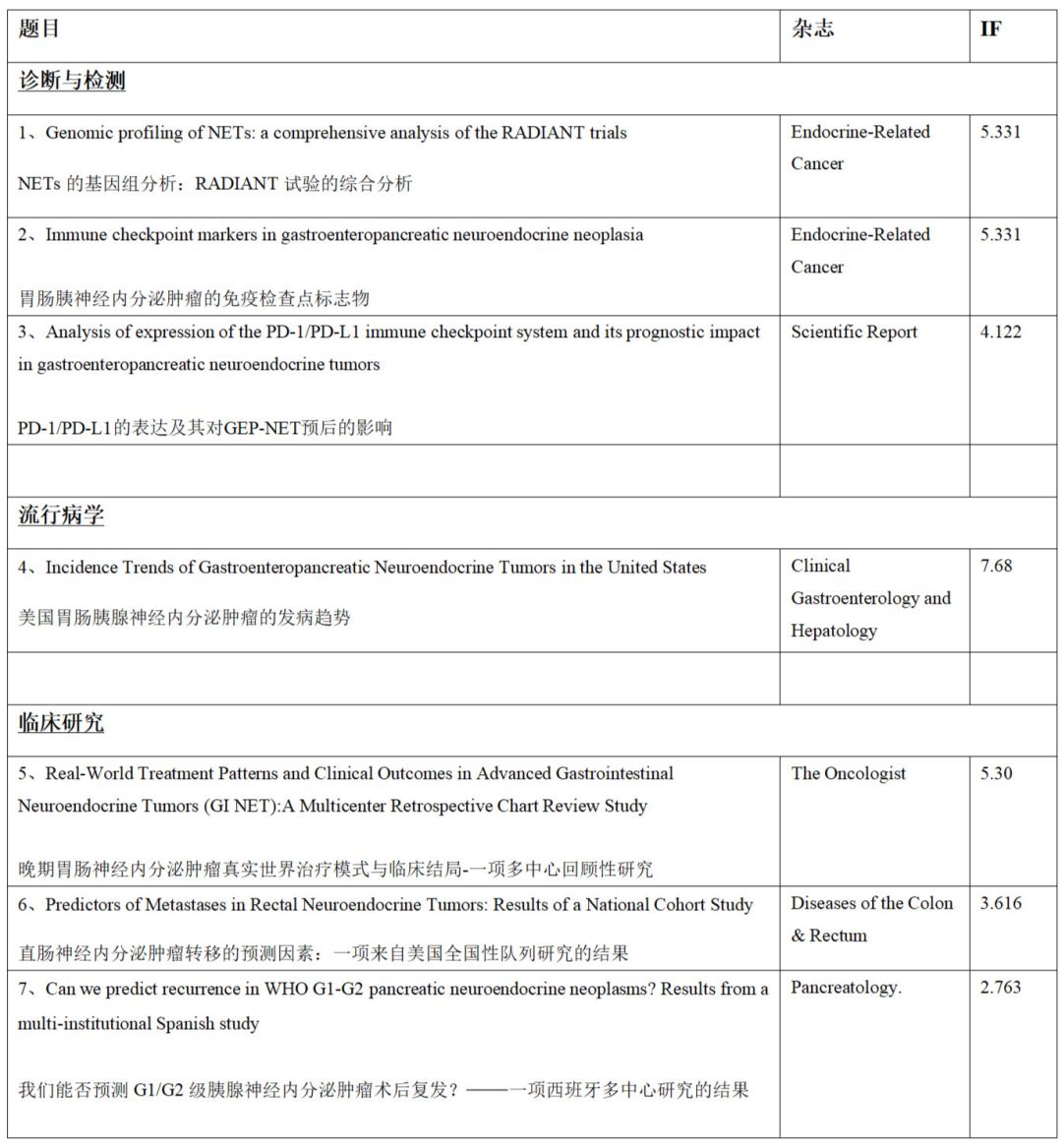
既往的神经内分泌肿瘤(NETs)分类方法是基于其组织学特征和解剖学起源位置。本研究描述了关于不同解剖起源的NETs的3项三期临床试验中患者的基因组改变,并评估了其与临床结果的潜在相关性。 本研究对RADIANT系列临床试验中收集的225个NET样品进行全外显子组和靶向组测序(NGS),同时分析了非基因相关生物标志物,如肿瘤分级、循环嗜铬粒蛋白A(CgA)以及神经元特异性烯醇化酶(NSE)水平。 研究结果显示,大规模染色体改变是NET的共同特征。尽管不同肿瘤亚型之间染色体改变的具体模式有所不同,但所有主要部位的原发NET中,都观察到普遍的染色体不稳定性(CIN)。如下图所示,在胰腺NET中,较高的CIN与较长的存活期潜在相关(HR,0.55,P=0.077);而在胃肠NET中,较低的CIN与较长的存活率相关(HR,0.44,P=0.0006)。 多因素分析表明,当与进展性晚期NET患者的其他临床数据相结合时,染色体水平的改变可提供重要的预后信息。大规模CIN是NET的一个共同特征,特定模式的染色体获得和丢失似乎对NET各亚型有独立的预后价值。然而,CIN在NET中的临床意义仍需要在较大的患者队列中进行验证,并需要进一步的机制研究来解释。
A:在胰腺NET中,较高的CIN与较长总生存期潜在相关(P=0.077);
B:而在胃肠NET中,较低的CIN与较长的无进展生存期相关(P=0.0006)
既往已经有一些小样本量的NET基因测序研究的报道,例如在胰腺神经内分泌肿瘤中,接近60%存在MEN1、DAXX和ATRX突变,最近也有突变率较低的DNA错配修复相关基因MUTYH、CHEK2和BRCA2的报道。而在小肠神经内分泌肿瘤领域,罕有复发突变的报道。本研究是来自NANETS主席James Yao进行的一项基因测序的研究,对RADIANT-2、RADIANT-3和RADIANT-4 研究中入组的部分病例共计225例肿瘤组织标本进行了NGS全外显子测序或靶向测序,肿瘤来源涵盖了胃肠胰腺及肺等多个器官,以便更好地了解神经内分泌肿瘤基因组学概况。
本研究pNET 65例全部来源于RADIANT-4研究,其中原发性31例,转移性34例。与之前报道的结果相似,MEN1(43%)、DAXX(28%)、ATRX(11%)、TSC2(6%)和PTEN(5%)是pNET中最常见的突变基因,其中DAXX与ATRX相互排斥,MEN1,DAXX与ATRX大多数是移码突变或其它有害突变,原发性和转移性之间没有显著差异。本研究同时探讨了基因组的改变与pNET临床治疗结果的关联,通过聚类分析将所有病例分为高CIN亚组和低CIN亚组,发现MEN1、DAXX与ATRX突变与高CIN亚组具有强烈的关联性,即高CIN亚组至少具有上述三个突变中的一个,而低CIN亚组仅有23%的样本存在这样的突变。通过研究分析,两个亚组的患者OS具有显著差异,高CIN亚组患者中位OS达到62.6月,相比之下低CIN亚组的患者中位OS仅有37.9月。
本研究对胃肠来源的89病例同样进行了分析。在GINET中发现仅少数突变反复出现,在SI NET中BCOR和CDKN1B是出现频次最高的两个,分别为5例和4例。在20例结直肠NET中发现仅有ATM突变出现在3例样本中。在与临床治疗效果关联的研究中,由于OS并没有达到事先指定的cutoff值,因此选择PFS用于预后评估。通过聚类分析,低CIN亚组具有显著更长的PFS (17.2月),高CIN亚组为8.2月,低CIN亚组疾病进展风险降低56%,这一结果与pNET大相径庭。
在34例肺来源的NET研究中,6例出现MEN1突变,但考虑可能均为丧失功能的突变。其他已知突变如mTOR、PI3K等均未检出。聚类分析研究结果显示CIN状态与PFS无关。
笔者回想到早在2018年初,《Nature》刊载了题目为“Chromosomal instability drives metastasis through a cytosolic DNA response”的封面文章。文章报道了CIN(染色体不稳定性)与肿瘤转移有着很大的相关性。CIN的出现和随后的耐受是肿瘤演化过程中的一个重要节点, CIN诱导癌细胞从高度代谢状态到间充质状态的转录转变,从转移性肿瘤的泛癌基因组分析解释了非整倍体在早期肿瘤发生的机制,CIN驱动人类转移瘤的形成。但是在本研究中CIN高低在不同组织来源的NET疾病中的影响截然不同,就像原文中作者的表述“puzzling”。研究者在讨论部分提到,这些观察结果表明,尽管CIN是所有NET中的共同特征,但它本身可能不会驱动肿瘤生物学,只是可能反映了疾病发展背后的维持染色体稳定的各种潜在缺陷。这一点也有待我们与NET治疗领域的专家继续深入的研究。
Yao JC, Garg A, Chen D, et al. Endocrine-Related Cancer. 2019 Jan 1.
doi: 10.1530/ERC-18-0332.
Immune checkpoint markers in gastroenteropancreatic neuroendocrine neoplasiaEndocrine-Related Cancer [IF=5.331]
许多肿瘤细胞表面可检测到程序化死亡受体及其配体的表达(PD-1及PD-L1)。近年来,肿瘤免疫治疗已经获得了重大突破,在多种肿瘤中显示出了明显获益。针对胃肠胰神经内分泌肿瘤(GEP-NENs)患者的免疫治疗的临床研究近年来也逐步开展,已经显示一定的临床获益,但临床可使用何种生物标志物来筛选适合免疫治疗的GEP-NENs,尚无统一的标准。本项研究即通过检测PD-1/PD-L1以及肿瘤淋巴浸润(TILs)等生物标志物,对GEP-NENs进行分类。
来自德国慕尼黑某医院1995年到2013年的244例经石蜡包埋的GEP-NENs肿瘤组织标本,根据WHO2017标准进行病理诊断,应用免疫组化方法检测了蛋白水平肿瘤组织中TILs、PD-1和PD-L1的表达。本研究的临床数据收集来源于病理医师的原始报告及前瞻性数据库,评估的临床变量包括人口统计学特点、原发肿瘤特征、组织病理特征、肿瘤病理分级及总生存期。
在本研究中,PD-L1阳性表达定义为>1%的肿瘤细胞膜染色阳性。TILs检测结果判定采用半定量,在每个组织芯片中,≥3个淋巴细胞浸润为高TIL水平,<3个淋巴细胞浸润为低TIL水平。
结果显示,大多数病人为小肠NEN(52.5%)或胰腺NEN(29.5%)。根据病理形态及Ki67指数对所有患者进行分级,57.8%为G1, 34%为G2, 8.2%为G3。肿瘤标志物的表达水平与患者临床病理参数相关。
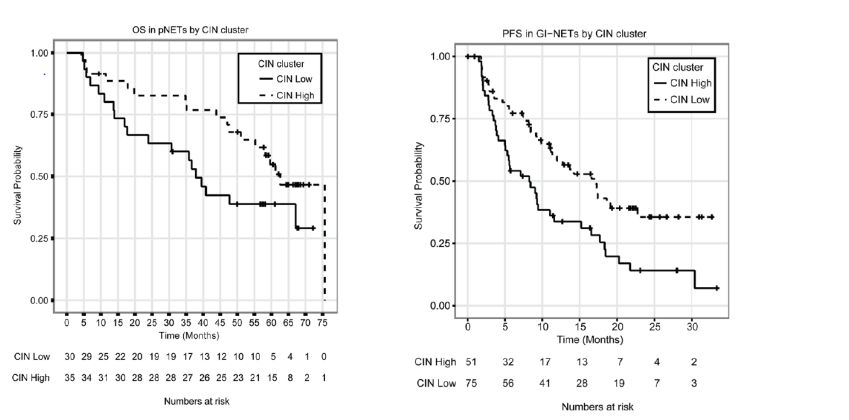
高TILs(19.6%)和高PD-1(16.1%)表达与患者生存期短(P<0.05)和病理分级高有关。此外, PD-L1表达阳性患者(8.7%)生存期有缩短的趋势。
本研究显示TIL未来可能可以作为一项生物标志物,指导GEP-NENs患者的免疫治疗。对于高TILs表达患者,免疫治疗可能会有较好的治疗前景。
A. 高TIL水平的GEP-NENs患者预后较差(P<0.05);
B. 高PD-1表达的患者预后较差(P<0.05)
Florian Bsch, Katharina Brüwer et al. Endocrine-Related Cancer (2019) 26, 293–301.
3. PD-1/PD-L1的表达及其对胃肠胰神经内分泌肿瘤预后的影响
Analysis of expression of the PD-1/PD-L1 immune checkpoint system and its prognostic impact in gastroenteropancreatic neuroendocrine tumorsScientific Report [IF=4.122]
基于免疫检查点的靶向程序性死亡-1(PD-1)受体及其配体PD-L1的疗法最近被批准用于治疗不同的恶性肿瘤,但尚未用于胃肠胰神经内分泌肿瘤(GEP-NETs)的治疗。在此背景下,本研究评估了GEP-NETs中PD-1/PD-L1的表达及其与临床预后的潜在相关性。研究者对116例GEP-NETs和48例肿瘤周围组织样品进行了免疫组化检测,分析了其PD-1 / PD-L1的表达。此外,通过流式细胞仪评估来自GEP-NETs(n=32)组患者和健康对照(n =32)组的外周血单核细胞(PBMC)以及肿瘤瘤内单核细胞(TMCs)(n=3)的分子表达。免疫组化结果提示,PD-L1和PD-1的表达在肿瘤组织内分别为6%和1%。而在肿瘤周围组织中,两种分子的表达均为8%。本研究还观察到,在诊断时,TMCs的PD-1表达与疾病的转移性相关;且在随访时,外周循环中PD-1 + PBMC的水平与疾病的进展相关。此外,循环中PD-1 + PBMCs与肿瘤细胞的PD-L1表达显著相关。该研究的数据表明PD-1 / PD-L1在GEP-NETs中表达为1%至8%,并且其特征与疾病进展显着相关(p<0.01)。

Miguel Sampedro-Núñez, et al, Scientific Report, December 13, 2018
Incidence Trends of Gastroenteropancreatic Neuroendocrine Tumors in the United StatesClinical Gastroenterology and Hepatology [IF=7.683]
虽然多项研究报道显示,过去几十年里胃肠胰神经内分泌肿瘤(GEP-NET)发病率不断上升,但有关其近期趋势的国家级数据有限。通过基于人群的注册研究,作者评估了1975年至2012年间,美国人群GEP-NET发病率的趋势,所统计数据包括年龄、诊断年份、和出生年份,以确定是否不同年龄组别的GEP-NET发病率均有升高。
作者使用组织和部位代码从最新版本的SEER数据库中收集1975至2012年间的GEP-NET病例。计算了年度总发病率、年龄校正的发病率(每十万人病例数)、年度百分比变化(APC)和5年期平均APC,并根据年龄、时期和出生年份分组评估了发病率。
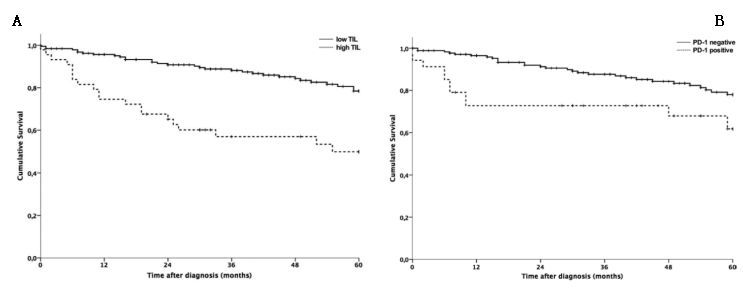
在筛选出的共计22,744例GEP-NET患者中,25-39岁的成人组,GEP-NET发病率在20世纪70年代中期到80年代初期逐渐下降,之后,直到2012年均持续升高。对于40岁及以上的成年人或15-24岁的年轻人,GEP-NET发病率从1975年到2012年总体上持续升高。40-69岁的成年人的平均每年增长率最快(每年约4%-6%)。70-84岁的成人总体发病率最高。自SEER注册登记开始以来,GEP-NET发病率在连续的出生队列中持续升高。
此研究显示,GEP-NET的发病率持续升高,中老年人发病率的升高最为显著。最近几代人的GEP-NET发病率高于更早的几代人。
Lee MR, Harris C, et al. Clinical Gastroenterology and Hepatology 2018 Dec 20.
pii: S1542-3565(18)31393-4.
5. 晚期胃肠神经内分泌肿瘤真实世界治疗模式与临床结局-一项多中心回顾研究
Real-World Treatment Patterns and Clinical Outcomes in Advanced Gastrointestinal Neuroendocrine Tumors (GI NET):A Multicenter Retrospective Chart Review Study
本研究评估了美国四个大型三级转诊中心中,晚期胃肠道(GI)神经内分泌肿瘤(NET)患者的治疗模式和疗效。
方法:作者回顾性分析了2011年7月至2014年12月期间治疗的年龄≥18岁的晚期NET患者,以患者组织学确诊为局部晚期/转移性GI NET的时间为诊断日期。分析了包括从诊断日期到最后一次随访或死亡之间的患者基线特征、治疗模式、进展、死亡以及GI NET相关的医疗保健资源利用的相关数据。使用Kaplan-Meier模型分析治疗中止时间、进展时间和总生存(OS)时间。
本研究最终纳入了273名符合条件的患者; 其中156例(57%)患有原发性回肠NET,174例(64%)患有功能性NET。一线治疗包括生长抑素类似物(SSAs)单药治疗(89%)或联合治疗(2%),肝脏靶向治疗(LDT; 8%)和细胞毒性化疗或干扰素(2%)。 155名患者继续接受二线治疗,包括SSAs单药(17%)或联合治疗(75%,其中3%联合肽受体放射性核素治疗),LDT(4%)和其他治疗(3%)。一线治疗停药的中位时间,SSAs为154.0个月,细胞毒性化疗为3.8个月。研究者评估的进展的总体中位时间为30.3个月。一线治疗应用后的中位OS,对于所有患者为151.8个月,一线使用SSA s的患者为178.9个月。
该研究说明了SSAs是GI NETs患者的一线治疗以及后续治疗中的常见联合药物,并提示了患者相对较长的生存期以及接受的多种额外治疗。在新治疗方案获得批准后,仍需要进一步进行治疗模式评估。
启示:该研究评估了GI NET长达30年的治疗模式,包括了SSAs、LDT、细胞毒化疗和干扰素等晚期胃肠道的常见治疗方法。 本研究结果提示,单独应用SSAs或以SSAs为主的与其他治疗联合的治疗方案是一线治疗和进展后的二线治疗的最常用的治疗模式。本研究中的患者长期维持SSAs治疗,其一线治疗的中位治疗时间为12.8年。鉴于最近FDA批准用于GI NET的其他额外的治疗,仍需更长时间的随访评估其治疗模式的有效性。
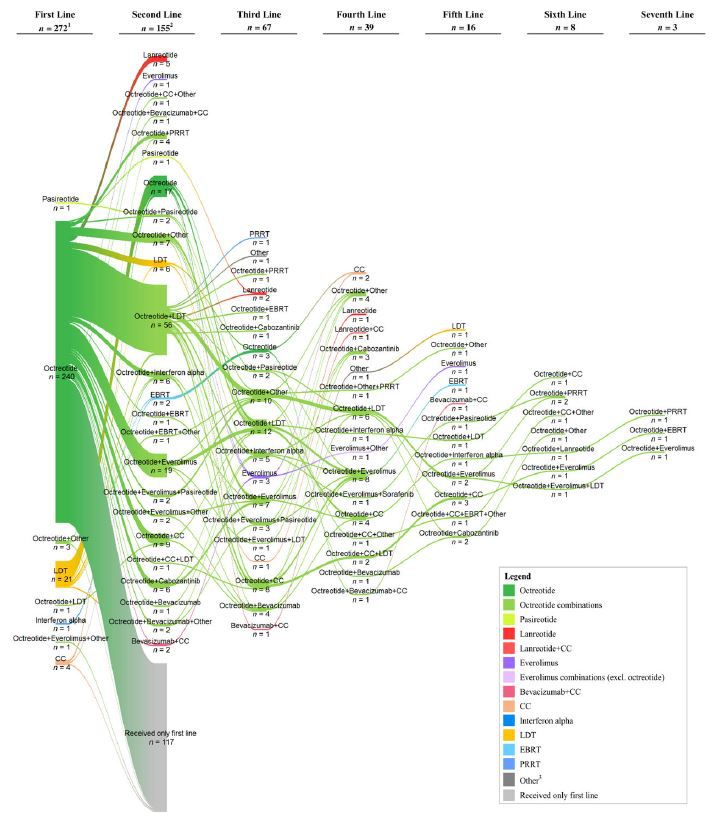 所有患者治疗顺序的桑基图。
所有患者治疗顺序的桑基图。
Matthew H. Kulke, et al, The Oncologist 2019;24:1–10
6、直肠神经内分泌肿瘤转移的预测因素:一项来自美国全国性队列研究的结果
Predictors of Metastases in Rectal Neuroendocrine Tumors: Results of a National Cohort StudyDiseases of the Colon & Rectum [IF=3.616]
直肠神经内分泌肿瘤经常在偶然就诊中被发现。对于直径≤2cm的肿瘤推荐局部切除病灶;然而这一治疗推荐的证据有限。所以该研究旨在探究肿瘤大小、肿瘤分化程度与肿瘤远处转移之间的关系。
该研究是一项使用全国性队列数据的回顾性研究。总共有4893例直肠神经内分泌肿瘤患者的数据被从美国国家癌症数据库的数据筛选出来。研究使用logistic回归分析来评价肿瘤大小、分化等级和肿瘤出现局部及远处转移之间的关系;并确定一个最佳的直径大小阈值来预测可能的远处转移。
该研究所分析的患者数据中,3880(79.3%)例为高分化的肿瘤,540(11.0%)例为中等分化肿瘤,473 (9.7%)为低分化肿瘤。通过logistic回归分析发现,更大的肿瘤大小与更高淋巴结转移风险相关;同时肿瘤大小及分化程度都与更高的远处转移风险独立相关。肿瘤大小与远处转移的相关性在高分化及中等分化的肿瘤中(OR = 1.4; P<0.001 ,两者皆是)比低分化的肿瘤更强(OR = 1.1;P=0.010)。在高分化的肿瘤中,预测出现远处转移的肿瘤直径的最佳临界值为1.15 cm (曲线下面积 0.88; 敏感度88%,特异度 88%)。肿瘤直径≥1.15cm与远处转移几率显著增加相关(72/449(13.8%))。在中等分化的肿瘤中,预测出现远处转移的肿瘤直径的最佳临界值也是1.15cm (曲线下面积 0.87; 敏感度100%,特异度75%)。
总之,该研究的结果提示肿瘤大小与分化程度可以预测直肠神经内分泌肿瘤局部及远处的转移。肿瘤直径≥1.15 cm的患者具有更高的远处转移的风险,因此需要相应的准确分期和治疗。
Concors S J , et al. Diseases of the Colon & Rectum, 2018; 61: 1372–1379
7、我们能否预测G1/G2 胰腺神经内分泌肿瘤术后复发?——一项西班牙多中心研究的结果
Can we predict recurrence in WHO G1-G2 pancreatic neuroendocrine neoplasms? Results from a multi-institutional Spanish study
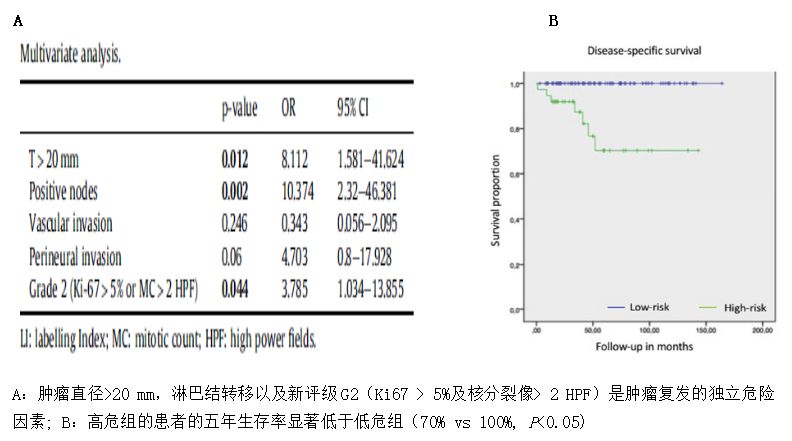
胰腺神经内分泌肿瘤(PNEN)是一种罕见的肿瘤,其中,高分化的PNEN生物学行为相对惰性。所以较少有研究调查与PNEN术后复发相关的因素。该研究的目的是探索能否预测PNEN中2017年WHO分级中G1/G2的患者术后的复发。
这是一项多中心的回顾研究,分析7家西班牙的医疗中心进行胰腺切除术的患者数据,只纳入2017年WHO分级中G1/G2的PNEN患者,分析其人口学特征及临床病理特征变量。总共137名患者的数据纳入了分析,平均年龄59.2岁,其中19人(13.9%)出现肿瘤复发。平均的无病生存期为55个月。通过多因素分析,研究者发现肿瘤直径>20 mm,淋巴结转移以及分级为G2级(Ki67 > 5%及核分裂像> 2 HPF)是肿瘤复发的独立危险因素。研究者应用这三个危险因素开发了一个危险度评分系统。高危组的患者的五年生存率显著低于低危组(70% vs 100%)。
该研究提出了一个基于淋巴转移、肿瘤直径>20 mm及新评级G2(Ki67 > 5%及核分裂像> 2 HPF)的复发危险度评分系统。如果患者有至少两个危险因素,预示其有更高的复发风险及显著更短的疾病相关生存;因此这一类的患者应该得到更加密切的监测,且应当通过临床试验评估辅助化疗在这类患者的作用。
Ausania F, et al. Pancreatology. 2019.
SAN19031293

徐近教授
复旦大学附属肿瘤医院胰腺外科
主任医师、博士生导师
中国抗癌协会青年理事会理事
中国抗癌协会胰腺癌专业委员会青委会副主任委员
中国医促会神经内分泌肿瘤分会青委会副主任委员
长期致力于改进胰肠吻合降低胰瘘发生的研究、胰腺癌个体化精准治疗的研究及胰腺神经内分泌肿瘤的综合治疗研究,获得3项国家自然科学基金及多项上海市级课题,以第一/通讯作者发表论文30余篇,并荣获上海市优秀发明金奖、上海市医学科技三等奖。





 京公网安备 11010502033352号
京公网安备 11010502033352号